 Führen Sie stöchiometrische Berechnungen durch, werden Sie evtl. auch weitere Informationen zu chemischen Elementen benötigen. Deshalb enthält das Programm auch ein Periodensystem der Elemente.
Führen Sie stöchiometrische Berechnungen durch, werden Sie evtl. auch weitere Informationen zu chemischen Elementen benötigen. Deshalb enthält das Programm auch ein Periodensystem der Elemente.
Am Ende des 18. Jahrhunderts waren etwa 30 chemische Elemente bekannt, um 1863 bereits 63. Diese stetig wachsende Anzahl forderte eine Systematik. So veröffentlichte Johann Wolfgang Döbereiner 1817 die Triaden, das sind vier Gruppen von je drei Elementen, welche gleiche Eigenschaften aufwiesen. Von Dimitrij I. Mendelejew wurde zwischen 1868 und 1871 das Periodensystem der Elemente in der noch heute gültigen Form geschaffen.
Dieses Hilfsmittel ist heute aus der Chemie und Atomphysik nicht mehr wegzudenken. So entdeckte Winkler 1886 das Element Germanium, das aufgrund theoretischer Überlegungen zum Aufbau des Periodensystems schon 15 Jahre früher von Mendelejew als Eka-Silicium mit seinen Eigenschaften vorhergesagt wurde.
In der modernen Form des Periodensystems sind die Elemente nach steigender Protonenzahl schematisch in sieben Perioden (horizontal) und acht Gruppen (vertikal) angeordnet. Diese Gruppen werden nochmals in Haupt- und Untergruppen eingeteilt und mit den Ziffern 0 bis 8 und einem „A“ für die Hauptgruppe und einem „B“ für die Nebengruppe bezeichnet.
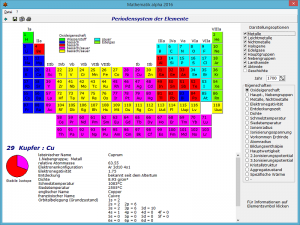
Innerhalb dieses Programms erhalten Sie die Darstellung eines solchen Langperiodensystems der Elemente. In der heute wissenschaftlich üblichen Form sind die Elemente von links nach rechts mit aufsteigender Ordnungszahl entsprechend ihrer Perioden dargestellt.
Da die Ordnungszahl gleich der Protonenzahl im Atomkern ist bzw. der Elektronenzahl in der Atomhülle entspricht, die Elektronen sich nun nach klaren Gesetzen anordnen müssen, entsteht die etwas merkwürdige Form des Periodensystems. Da auf der ersten Elektronenschale nur zwei Elektronen Platz finden, kann die 1. Periode auch nur zwei Elemente, Wasserstoff und Helium, enthalten. Acht Elektronen auf der zweiten Schale bewirken, dass die 2. Periode genau acht Elemente (Lithium bis Neon) enthält. Die möglichen 18 Elektronen der 3. Schale garantieren allerdings nicht 18 verschiedene Elemente der 3. Periode. Hier und bei den weiteren Elektronenschalen sind die Verhältnisse komplizierter.
In das Periodensystem werden die Ordnungszahlen und die Elementsymbole eingetragen. Der Hintergrund eines jeden Elements wird entsprechend einer Option, einer chemischen oder physikalischen Eigenschaft der Elemente, eingefärbt. Über die Auswahlfelder Eigenschaften haben Sie die Möglichkeit, diese Option zu wählen unter einer Färbung in Abhängigkeit von
- den Eigenschaften der Oxide (Voreinstellung)
- Metall- und Nichtmetalleigenschaften
- den Haupt- und Nebengruppen
- der Elektronegativität
- der Entdeckungszeit
- der Dichte
- dem Atom- und Ionenradius
- der Ionisierungsspannung, dem 2. und 3. Ionisierungspotential
- dem Vorkommen in der Erdrinde
- der Bildungsenthalpie
- der Hauptwertigkeit
- der Schmelz- bzw. Siedetemperatur
- der Kristallstruktur
- dem Aggregatzustand bei 20 °C
- der spezifischen Wärmekapazität
bzw. ein „leeres“ Periodensystem.
Je nach gewählter Farbgebung wird zusätzlich eine Legende dargestellt, welche die verwendete Farbabstufung kennzeichnet.
Wählen Sie die Darstellung entsprechend dem Aggregatzustand, so wird voreingestellt eine Temperatur von 20°C angenommen. An den nun zusätzlich sichtbaren Pfeilschaltern können Sie die Temperatur verändern.
Zusätzlich können Sie unter den Darstellungsoptionen einige Elementgruppen:
Metalle, Nichtmetalle, Leichtmetalle, Halogene (7. Hauptgruppe), Edelgase (8. Hauptgruppe), Hauptgruppen, Nebengruppen, Lanthanide, „Seltene Erden“ (Elemente 58 bis 71), Aktinide (Elemente 90 bis 103), Geschichte
wahlweise zu- oder abschalten. Beachten Sie bitte, dass im Programm der Bereich der Nichtmetalle nicht die Halogene enthält. Diese werden gesondert betrachtet. Zur Option Geschichte lesen Sie bitte weiter unten.
Klicken Sie mit der linken Maustaste eines der chemischen Elemente des Periodensystems an, erhalten Sie weitergehende Informationen. Dazu gehören:
- vollständiger deutscher Elementname und in Klammern der lateinische Name
- Hauptgruppe, bzw. Nebengruppe, Charakter der Hauptgruppe
- relative Atommasse, Elektronenkonfiguration, Elektronegativität, Dichte bei 20°C
- Entdeckungsjahr und Entdecker
- Schmelz- und Siedetemperatur
- und die Orbitalbelegung im Grundzustand
Darstellungsoption Geschichte
Wählen Sie die Darstellungsoption Geschichte, so können Sie schrittweise die Geschichte der Entdeckung der chemischen Elemente beginnend im Jahr 1600 bis heute nachvollziehen. Wie schon oben erwähnt, waren Ende des 18. Jahrhunderts nur wenige chemische Elemente bekannt.
| Periodensystem der Elemente | |
|---|---|
 |
|
| Herunterladen | |
Das Programm zeigt Ihnen, angeordnet in dem Langperiodensystem, für das jeweils an den Pfeilschaltern eingestellte Jahr alle bis dahin bekannten Elemente an – z.B. waren 1700 erst 13 chemische Elemente als solche erkannt.
Ändern Sie das Jahr am Rollbalken, wird sofort eine entsprechende Änderung der Elemente vorgenommen. Für einige damals noch fehlende Elemente wurden Lücken gelassen.