 In dem Werk „Optik“ schreibt Isaac Newton:
In dem Werk „Optik“ schreibt Isaac Newton:
„In einem sehr dunklen Zimmer brachte ich hinter einer runden, in dem Fensterladen befindlichen Öffnung von 1 / 3 Zoll Durchmesser ein Glasprisma an. Letzteres sollte den Lichtstrahl, der durch die Öffnung eindrang, ablenken, ihn aufwärts nach der gegenüberliegenden Wand des Zimmers werfen und dort ein farbiges Bild der Sonne erzeugen. …
Das Spektrum war farbig, und zwar rot in seinem am wenigsten gebrochenen Ende, violett dagegen in dem am stärksten abgelenkten Ende. Der dazwischen befindliche Raum war gelb, grün und blau.“
Die Entdeckung Newtons leitete eine neue Etappe der Optik ein und veranlasste eine Vielzahl von Wissenschaftlern, darunter auch Goethe, sich auf das Gebiet der Physik zu begeben. Fällt weißes Licht durch ein Glasprisma, so wird dieses Licht je nach Eigenschaft des Prismenmaterials in seine Bestandteile, sprich die Spektralfarben zerlegt.
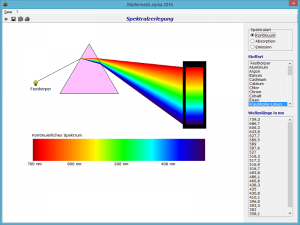
Wurde das Licht z.B. von einem glühenden Festkörper emittiert, so entsteht nach der spektralen Zerlegung das allgemein bekannte farbige Band, beginnend bei Rot über Grün, Gelb bis Blau und Violett. Dieses Spektrum nennt man ein kontinuierliches Spektrum oder kurz Kontinuum.
Nach dem Start dieses Teilprogramms wird ein derartiges Spektrum gezeichnet. Mithilfe der wissenschaftlichen Methode der Spektralanalyse können aus dem Spektrum Aussagen über die stoffliche Zusammensetzung des leuchtenden Stoffes oder aber über den Weg des Lichts von der Lichtquelle zum Prisma getroffen werden.
Absorptionsspektrum
Durchläuft weißes Licht (Kontinuum) z.B. ein Gas, so absorbieren die Gasmoleküle ganz bestimmte, elementspezifische Farben. Das entstehende Spektrum ist ein kontinuierliches Spektrum mit zusätzlichen schwarzen Linien, ein Absorptionsspektrum.
Emissionsspektrum
Wird das Licht von einem leuchtenden Gas ausgesandt, werden nur ganz bestimmte Wellenlängen – je nach Element – gesendet. Das entstehende Spektrum bleibt schwarz und enthält einige farbige Einzellinien, ein Emissionsspektrum.
Absorptions- und Emissionsspektrum können Sie ebenso darstellen. Wählen Sie zuerst links die Art des Spektrums und anschließend einen Stoff in der Liste (32 Stoffe enthalten) aus.
Das Programm zeichnet sofort das entsprechende Spektrum. In der zweiten Liste finden Sie die Wellenlängen der elementtypischen Spektrallinien in 10-8 m.
| Spektralzerlegung, Dispersion | |
|---|---|
 |
|
| Herunterladen | |
Innerhalb der Stoffliste finden Sie den Eintrag Fraunhofer-Linien. Josef Fraunhofer untersuchte als einer der ersten intensiv das Sonnenspektrum und entdeckte dabei die in der Sonnenchromosphäre und Korona entstehenden Absorptionslinien, die nach ihm benannt wurden. Das Programm stellt Ihnen die neun wichtigsten der in Wirklichkeit mehreren Hunderten Linien dar. Beachten Sie, dass diese Linien durch unterschiedliche chemische Elemente hervorgerufen werden.